DEFINICIÓN
Los alcoholes son compuestos orgánicos caracterizados por la presencia de uno o más radicales hidroxilo (-OH) en la estructura de la molécula orgánica.
Los alcoholes son compuestos orgánicos caracterizados por la presencia de uno o más radicales hidroxilo (-OH) en la estructura de la molécula orgánica.
 |
CLASIFICACIÓN DE LOS ALCOHOLES
Los alcoholes se clasifican en primarios, secundarios y terciarios, dependiendo del carbono funcional al que se una el grupo hidroxilo.
- Alcohol primario: se utiliza la Piridina (Py) para detener la reacción en el aldehído Cr03 / H+ se denomina reactivo de Jones, y se obtiene un ácido carboxílico.
- Alcohol secundario: se obtiene una cetona + agua.
- Alcohol terciario: si bien se resisten a ser oxidados con oxidantes suaves, si se utiliza uno enérgico como lo es el permanganato de potasio, los alcoholes terciarios se oxidan dando como productos una cetona con un número menos de átomos de carbono, y se libera metano.
Y a su vez los alcoholes se pueden clasificar según el número de grupos hidroxilos que contenga el compuesto:
- Monoalcohol o Monol: Son alcoholes que tienen un solo grupo hidroxilo (–OH), y son aquellos que pueden clasificarse como alcoholes primarios, secundarios y terciarios.
- Polialcoholes: Son compuestos que tienen dos o más grupos hidroxilos (–OH).
NOMENCLATURA DE LOS ALCOHOLES
1. Se elige como cadena principal la de mayor longitud que contenga el grupo -OH.

2. Se numera la cadena principal para que el grupo -OH tome el localizador más bajo. El grupo hidroxilo tiene preferencia sobre cadenas carbonadas, halógenos, dobles y triples enlaces.
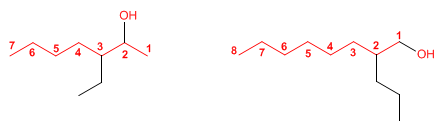
3. El nombre del alcohol se construye cambiando la terminación -o del alcano con igual número de carbonos por -ol
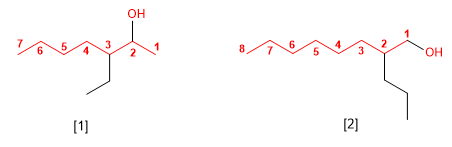
4. Cuando en la molécula hay grupos grupos funcionales de mayor prioridad, el alcohol pasa a serun mero sustituyente y se llama hidroxi-. Son prioritarios frente a los alcoholes: ácidos carboxílicos, anhídridos, ésteres, haluros de alcanoilo, amidas, nitrilos, aldehídos y cetonas.
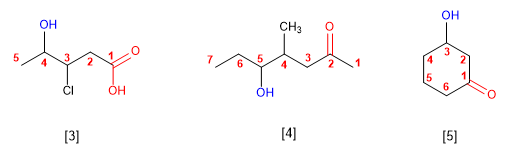
5. El grupo -OH es prioritario frente a los alquenos y alquinos. La numeración otorga el localizador más bajo al -OH y el nombre de la molécula termina en -ol.
Observen el siguiente video:
USOS DE LOS ALCOHOLES
El Metanol: aplicaciones
El Etanol: aplicaciones
El compuesto químico etanol, conocido como alcohol etílico, es un alcohol que se presenta en condiciones normales de presión y temperatura como un líquido incoloro e inflamable con un punto de ebullición de 78 °C.
Mezclable con agua en cualquier proporción; a la concentración de 95% en peso se forma una mezcla azeotrópica.
Su fórmula química es CH3-CH2-OH (C2H6O), principal producto de las bebidas alcohólicas como el vino (alrededor de un 13%), la cerveza (5%) o licores (hasta un 50%).
Sus Efectos en el Organismo
PROPIEDADES FÍSICAS
| Las propiedades físicas de un alcohol se basan principalmente en su estructura. El alcohol esta compuesto por un alcano y agua. Contiene un grupo hidrofóbico (sin afinidad por el agua) del tipo de un alcano, y un grupo hidroxilo que es hidrófilo (con afinidad por el agua), similar al agua. De estas dos unidades estructurales, el grupo –OH da a los alcoholes sus propiedades físicas características, y el alquilo es el que las modifica, dependiendo de su tamaño y forma. | |||||||||||||
El grupo –OH es muy polar y, lo que es más importante, es capaz de establecer puentes de hidrógeno: con sus moléculas compañeras o con otras moléculas neutras.
| |||||||||||||
Solubilidad:
Puentes de hidrógeno: La formación de puentes de hidrógeno permite la asociación entre las moléculas de alcohol. Los puentes de hidrógeno se forman cuando los oxígenos unidos al hidrógeno en los alcoholes forman uniones entre sus moléculas y las del agua. Esto explica la solubilidad del metanol, etanol, 1-propanol, 2-propanol y 2 metil-2-propanol.
| |||||||||||||
|
| ||||||||||||
A partir de 4 carbonos en la cadena de un alcohol, su solubilidad disminuye rápidamente en agua, porque el grupo hidroxilo (–OH), polar, constituye una parte relativamente pequeña en comparación con la porción hidrocarburo. A partir del hexanol son solubles solamente en solventes orgánicos.
| |||||||||||||
|
| ||||||||||||
| Existen alcoholes de cuatro átomos de carbono que son solubles en agua, debido a la disposición espacial de la molécula. Se trata de moléculas simétricas. | ||||||||||||
Existen alcoholes con múltiples moléculas de OH (polihidroxilados) que poseen mayor superficie para formar puentes de hidrógeno, lo que permiten que sean bastante solubles en agua.
|
| ||||||||||||
| Punto de Ebullición: Los puntos de ebullición de los alcoholes también son influenciados por la polaridad del compuesto y la cantidad de puentes de hidrógeno. Los grupos OH presentes en un alcohol hacen que su punto de ebullición sea más alto que el de los hidrocarburos de su mismo peso molecular. En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones. | ||||||||||||
| El punto de fusión aumenta a medida que aumenta la cantidad de carbonos. |
| ||||||||||||
Densidad: La densidad de los alcoholes aumenta con el número de carbonos y sus ramificaciones. Es así que los alcoholes alifáticos son menos densos que el agua mientras que los alcoholes aromáticos y los alcoholes con múltiples moléculas de –OH, denominados polioles, son más densos. (Constantes Físicas de algunos alcoholes)
| |||||||||||||
| |||||||||||||
PROPIEDADES QUÍMICAS:
| |||||||||||||
| Los alcoholes pueden comportarse como ácidos o bases, esto gracias al efecto inductivo, que no es más que el efecto que ejerce la molécula de –OH como sustituyente sobre los carbonos adyacentes. Gracias a este efecto se establece un dipolo. | |||||||||||||
La estructura del alcohol está relacionada con su acidez. Los alcoholes, según su estructura pueden clasificarse como metanol, el cual presenta un sólo carbono, alcoholes primarios, secundarios y terciarios que presentan dos o más moléculas de carbono.
| |||||||||||||
| |||||||||||||
| |||||||||||||
Debido a que en el metanol y en los alcoholes primarios el hidrógeno está menos firmemente unido al oxígeno, la salida de los protones de la molécula es más fácil por lo que la acidez será mayor en el metanol y el alcohol primario.
| |||||||||||||
Deshidratación: la deshidratación de los alcoholes se considera una reacción de eliminación, donde el alcohol pierde su grupo –OH para dar origen a un alqueno. Aquí se pone de manifiesto el carácter básico de los alcoholes. La reacción ocurre en presencia de ácido sulfúrico (H2SO4) en presencia de calor.
| |||||||||||||
|
La deshidratación es posible ya que el alcohol acepta un protón del ácido, para formar el alcohol protonado o ión alquil hidronio.
| ||||||||||||
El alcohol protonado pierde una molécula de agua y forma un ión alquil-carbonio:
|
| ||||||||||||
El ión alquil-carbonio pierde un protón lo que regenera la molécula de ácido sulfúrico y se establece el doble enlace de la molécula a la cual está dando origen el alcohol.
| |||||||||||||
El calentamiento de un alcohol en presencia de ácido sulfúrico a temperaturas inferiores a las necesarias para obtener alquenos producirá otros compuestos como éteres y ésteres.
| |||||||||||||
Obtención de alcoholes: al igual que a partir de los alcoholes se pueden obtener otros compuestos, los alcoholes pueden ser obtenidos a partir de hidratación o hidroboración – oxidación de alquenos, o mediante hidrólisis de halogenuros de alquilo. Para la obtención de alcoholes por hidratación de alquenos se utiliza el ácido sulfúrico y el calor.
| |||||||||||||
| La hidroboración: (adición de borano R3B) de alqueno en presencia de peróxido de hidrógeno (H2O2) en medio alcalino da origen a un alcohol. |
| ||||||||||||
|
La hidrólisis: de halogenuros de alquilo o aralquilo se produce en presencia de agua y hidróxidos fuertes que reaccionan para formar alcoholes.
| ||||||||||||










No hay comentarios:
Publicar un comentario